historia da Ciencia
Equivalente mecánico da calor
Este enlace ilustra o experimento de Joule (1843) no que determinou o equivalente mecánico da calor. Chegou á conclusión de que a calor é unha forma de enerxía, como tamén o é a enerxía potencial. Por iso interconvértense.

Este experimento xunto con outros levou ao establecemento dun dos principios máis importantes da Física: o Principio de Conservación da Enerxía.
A lámpada de Davy
Nas minas de carbón xérase habitualmente unha importante cantidade de CH4 (metano) que, en presenza de aire (O2) e unha fonte de ignición (chama) é explosivo, pois inflámase con moita facilidade. Por iso as lámpadas de chama dos mineiros eran moi perigrosas. Aquí tedes un interesante artigo tomado do magnífico blog de Daniel Torregrosa “Ese punto azul pálido”, sobre a invención da lámpada que pretendía rematar cos accidentes nas minas:
**ATENCIÓN !!! Nunca reproduzades na casa os experimentos que aparecen nos vídeos, porque non controlades todas as variables e podedes ter un gravísimo accidente.
“La lámpara de Davy
Hoy contaremos brevemente la historia de una de estas invenciones, una lámpara diseñada para acabar con la sangría de las muertes de los trabajadores -muchas veces niños- en las explotaciones mineras británicas de principios de siglo XIX, y que nos sirve como una lección más sobre cómo el mal uso de un genial y útil artilugio, aporta un capítulo más a la historia de la infamia.
Los lectores de este blog que hayan estudiado un poco de química, reconocerán la figura de Sir Humphry Davy (1778-1829) como una de las personalidades más emblemáticas de esta disciplina científica. Davy es considerado como uno de los padres de la electroquímica, junto con Volta y Faraday, fue el descubridor de una serie de elementos químicos -aplicando su dominio de la electrólisis- y todo un personaje mediático de su época, siendo muy populares sus conferencias en las que empleaba habitualmente el gas de la risa (óxido nitroso). Pero esa es otra historia, como la que le llevó a pronunciar su célebre frase: “Faraday es mi mayor descubrimiento”. [Volveré a Davy algún día para contarla. 😉]
En 1815, la Sunderland Society for the Prevention of Accidents in Mines, tras una serie de gravísimos accidentes ocurridos en las minas del norte de Inglaterra causados por explosiones de gas grísú, encargó a Davy una solución para evitar más desgracias. Davy había descubierto un par de años antes en sus investigaciones que si se rodeaba una llama con una fina gasa metálica, el calor desprendido por ésta no inflamaba el gas del ambiente exterior. Un fenómeno que se puede observar bastante bien en este vídeo:
Davy consiguió diseñar un prototipo que empleaba un cilindro de malla metálica que rodeaba a la llama de la lámpara. De esta manera se impedía que el calor desprendido inflamara el gas peligroso que podía estar presente (metano contenido en el grisú) y por tanto la peligrosa propagación de la llama. El funcionamiento de la lámpara lo podemos ver de forma más detallada en esta imagen:
 |
| Lámpara de Davy |
La lámpara de Davy alumbraba la oscuridad de la mina y no representaba una fuente de ignición en presencia de grisú (metano). Atrás quedaba la peligrosa época en que se iluminaba con velas enganchadas a una pértiga. Sin embargo, como en tantos otros inventos y descubrimientos, hubo cierta polémica en cuanto en la autoría del mismo. George Stephenson, minero e hijo de un peón minero, había desarrollado un modelo muy similar unos años antes que Davy. Al final, tras una serie de disputas y reclamaciones prevaleció el nombre de Davy para la lámpara, aunque se reconoció también la labor de Stephenson, quién centró sus esfuerzos posteriores en desarrollar la locomotora de vapor.
Pero esta feliz historia no lo es tanto. Un invento que se diseñó para evitar accidentes y mejorar la seguridad frente a explosiones, tuvo durante un tiempo el efecto contrario. Los explotadores de las minas comenzaron a adquirir, o fabricar ellos mismos, la lámpara de Davy; una lámpara de la que el mismo Davy renunció a la patente. Se dió la circunstancia de que minas que habían sido cerradas por su peligrosidad por presencia de atmósferas explosivas, fueron abiertas de nuevo. La seguridad que ofrecía la lámpara de Davy provocó que hubieran más accidentes y muertes al aumentarse la producción minera, sin tener en cuenta otras mejoras en la seguridad. Los trabajadores eran obligados a trabajar en condiciones extremadamente peligrosas con la perversa garantía de que la lámpara era segura para las explosiones -que lo era-, pero en realidad no evitaba el resto de factores de riesgo.
No obstante esta pequeña historia merece un final con mensaje positivo: La lámpara de Davy/Stephenson fue toda una revolución en su época. Ciencia y técnica al servicio de una clase trabajadora que sufría las consecuencias de unas condiciones miserables de explotación laboral. Fue una pieza en la esperanza de iluminar el oscuro túnel de salida hacia un mañana mejor que ayer.
Finalmente fue sustituida por otro tipo de sistemas de iluminación con la llegada de la electricidad.
ACTUALIZACIÓN (15/04/2012): Impresionante vídeo de los chicos de la universidad de Nottingham (Periodic Videos) donde se explica el invento de Davy y se muestran planos de su prototipo y la lámpara original.”
O sono do benceno
- Recollemos aquí unha copia do artigo “El sueño del benceno”, extraído do interesante blog “Flagellum. Impulsando la comprensión de la Ciencia“.
“El sueño del benceno.
En 1929 Kathleen Lonsdale con sus gafas de rayos x logró desvelar una pregunta que tenía en vilo a muchos químicos, la disposición de los átomos en la volatil estructura del benceno. Una simple pero escurridiza molécula de seis carbonos y seis hidrógenos que forma un anillo. En concreto publica ‘La estructura del anillo de Benceno en el hexametil benceno’. Es la confirmación más o menos directa de de lo que ocurría en esta extraña y controvertida molécula y sus muchos e importantes derivados. Contó el gran químico Kekulé que la estructura cíclica, hexagonal y resonante del benceno se le ocurrió en un sueño mientras dormitaba frente a la chimenea de su casa de Gante. Soñó con una serpiente que se muerde la cola el Ouroboros de la alquimia, no se sabe si es cierto pero es una de la flipadas más conocidas de la química. Pero volvamos a Kathleen ella comprobó el sueño, más o menos.
La idea de Kekulé de un anillo de seis carbonos, con dos formas resonantes era indudablemente una solución muy elegante y explicativa. Pero, cómo era la naturaleza de este anillo, era plano o deformado, tenía un solo centro de simetría o no, todavía quedaban muchas preguntas para explicar sus propiedades, aromaticidad, reactividad, estabilidad etc.
En el periodo de entre guerras, a finales de los 20 la cristalografía de rayos X estaba lista para abordar la estructura de moléculas orgánicas como el benceno, o empezaba a estarlo. Kathleen Londsdale debido a los problemas para obtener datos de los cristales de benceno (que es un líquido a temperatura ambiente), decidió utilizar para estudiar el anillo aromático un derivado el hexametil benceno, que era cristalino, estable y mostraba una única molécula por celda unidad, lo que facilitaba la interpretación de los datos cristalográficos. Además, no tenía ordenadores ni los procedimientos matemáticos que luego ella misma pondría en funcionamiento. Kathleen Lonsdale mostró en este trabajo, sin duda que el anillo era plano, hexagonal como en el grafito y que además poseía una nube electrónica uniformemente distribuida haciendo las veces de los tres dobles enlaces.
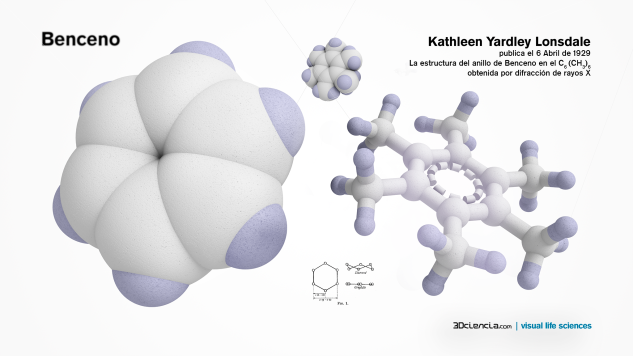
Kathleen Lonsdale publica el 6 Abril de 1929
La estructura del anillo de Benceno en el hexametil benceno C6 (CH3)6
obtenida por difracción de rayos X. En la figura se ve la planaridad del hexágono formado por los seis átomos de carbono. El hexametil benceno también muestra una estructura casi plana, con los metilos sustituyendo a los hidrógenos.
Paralelamente o casi en 1931 Erich Hückel, un fisico-químico alemán, mediante el desarrollo de métodos resolubles con mecánica cuántica para tratar con moléculas orgánicas con doble enlaces, logró explicar la estabilidad del benceno mediante los enlaces sigma, seis situados en el plano del anillo y los seis electrones pi situados perpendicularmente por encima y por debajo del plano, algo así como una doble corona de santo.
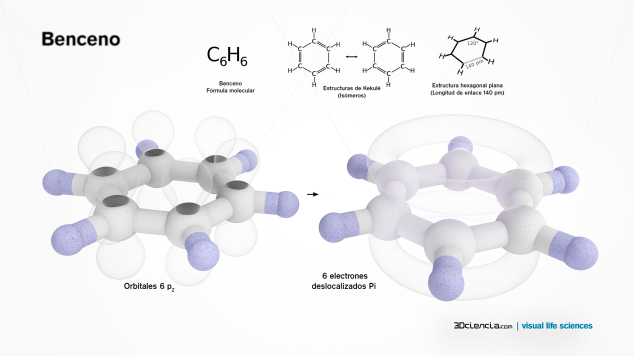
La difracción de rayos x muuestra que los seis enlaces carbono-carbono en el benceno tienen la misma longitud, 140 picometros (pm). Los enlaces C-C tienen una longitud mayor que un doble enlace C=C (135 pm) y más corto que un enlace C-C simple (147 pm). Esta distancia intermedia es consistente con la deslocalización de los electrones: los electrones de los enlaces C-C se distribuyen homogéneamente entre cada uno de los seis átomos de carbono. La molécula tiene 6 hidrógenos en el plano. La descripción en orbitales moleculares conlleva la formación de tres orbitales Pi deslocalizados sobre los seis átomos de C. La descripción de Enlace de Valencia implica la superposición de estructuras resonantes. Esta estabilidad contribuye a las peculiares propiedades químicas y moleculares denominada aromaticidad. Se representa mediante un hexágono con un círculo dentro.
Ese mismo 1931 ya trabajando con W. H. Bragg en la Royal Institution año Kathleen Londsdale publicó ‘Análisis de rayos x de la estructura del hexaclorobenceno, utilizando el método de Fourier’.En este trabajo aplicó por primera vez el método de fourier para calcular las posiciones de los átomos. Aunque los resultados de este trabajo no concluían con suficiente precisión si el anillo de benceno en el hexaclorobenceno era plano o no, suponía un avance en los métodos matemáticos de cálculo, que luego ganarían en resolución e importancia.
Este es un momento no super crucial, sino de esos que producen los pequeños cambios que asientan el plano para nuevas ideas. Como el benceno es la base de los compuestos aromáticos, el descubrimiento hizo posible nuevas incursiones para abundar en su química ya basadas en más que suposiciones. Kathleen Lonsdale fue un pionera en muchos aspectos, la primera mujer que junto con la microbióloga Margaret Stephenson, miembro de la Royal Society en 1945. También fue primera mujer profesor en la University College de Lóndres UCL y la primera presidenta de la Unión Internacional de Cristalografía en 1966 UICr y de la Asociación Británica para la Ciencia en 1968.
Se hizo Cuáquera en 1936 y fue encarcelada en Inglaterra por su activa objeción de conciencia durante la Segunda guerra mundial. Fue una constante activista que no encontró ningún problema entre la ciencia y su Fe. De hecho escribió ‘¿Es posible la Paz? 1957’ y ‘La vida cristiana vivida experimentalmente’ 1976.
NOTA: Esta entrada participa en la XI Edición del Carnaval de Química que celebra el blog La Aventura de la Ciencia @monzonete.
REFERENCIAS
Lonsdale, K. (1929). “The Structure of the Benzene Ring in Hexamethylbenzene”. Proceedings of the Royal Society 123A: 494.
The Structure of the Benzene Ring. K. LONSDALE. Nature 122, 810 (24 November 1928) | doi:10.1038/122810c0
Industria química e siderurxia en Langreo





Detección de ondas gravitacionais

Hoxe, 11-2-2016, confírmase a existencia de ondas gravitacionais. Un interesante achado para a cosmoloxía que nos permitirá coñecer o que sucedía no Universo instantes despois do Big-Bang. Chegan a nós estas ondas procedentes da fusión de dous buracos negros supermasivos (29 e 36 veces respectivamente a masa do noso Sol) que tivo lugar hai 1300 millóns de anos e que xerou un novo buraco de 62 veces a masa do noso Sol. As 3 masas solares de diferenza (29+36=65; 65=62+3) transformáronse en enerxía. E esta enerxía xerada na colisión propagouse polo espazo en forma de ondas gravitacionais que foron detectadas no LIGO (Observatorio de Interferometría LÁSER de Ondas Gravitacionais, situado en Estados Unidos).


A interferometría LÁSER permite detectar a perturbación que a presenza dunha destas ondas pode xerar na lonxitude dun túnel polo que circula un feixe de luz LÁSER. A técnica consiste nun feixe LÁSER que é dividido en dous camiños perpendiculares entre sí (dous túneles en forma de L de brazos iguais de 4km de lonxitude). Ao chegar ao final do brazo, cada LÁSER rebota contra un espello e volve.


Detéctase a suma dos sinais procedentes da luz de retorno nos dous brazos. Cando unha onda gravitacional está presente, produce a contracción dun dos brazos, así que a luz procedente dos dous brazos non chega ao detector ao mesmo tempo, e isto produce un sinal diferente no detector, pois os feixes de luz interfiren de xeito distinto. Este sinal é o testigo de que, efectivamente, cambiou a lonxitude dun dos camiños.

Tal como prediciu Einstein no ano 1916, unha onda gravitacional perturba o espazo-tempo, así que pode modificar a lonxitude dun dos túneles polos que circulan os feixes LÁSER. Sabede que esta modificación que a onda gravitacional produce na lonxitude do túnel de 4km é do tamaño da dezmilésima parte do diámetro do núcleo atómico (algo así como o tamaño dun balón de fútbol comparado co da Vía Láctea), pero o detector do LIGO é a ferramenta máis sensible do mundo.
Einstein dicía que os obxectos con masa deforman ao seu paso o espazo e o tempo, como unha bola nunha tela elástica. Esta transformación do espazo fíxose patente no acortamento da lonxitude do túnel do LIGO a causa da presenza dunha onda gravitacional.

Einstein xa predixera a existencia das ondas gravitacionais dentro da súa Teoría Xeral da Relatividade. A cantidade de materia implicada na colisión entre buracos negros produce unha pérdida de masa que se converte nunha altísima cantidade de enerxía (E=mc2), enerxía que despois se propagaría polo Universo en forma de ondas gravitacionais. Estas ondas deformarían o espazo-tempo ao seu paso. Por fin podemos dicir que xa foron detectadas co interferómetro do LIGO.
Ábrese un importantísimo camiño á astronomía e cosmoloxía, pois podemos explorar o Universo non soamente analizando a radiación electromagnética (luz de diferentes lonxitudes de onda) que nos chega, senon tamén a través do estudo destas ondas, cuxo comportamento parece semellante ao das ondas de son. Agora poderemos analizar obxectos distantes que non se poden ver con luz, como os buracos negros, e analizar eventos que non soamente xeran luz, senon tamén ondas gravitacionais.
Aparte de LIGO, este ano comezará a funcionar unha versión mellorada doutro gran observatorio de ondas gravitatorias en Europa: VIRGO. Ademais, tamén lanzouse o LISA Pathfinder, unha misión de demostración para un futuro observatorio espacial deste tipo de fenómenos.
- Preme aquí para ler máis sobre buracos negros.

O mol como unidade de cantidade de substancia
Post do blog da Facultade de Ciencia e Tecnoloxía da Universidade do País Vasco:
“4/10/1971: el mol como unidad de sustancia
Published 04/10/2015 Aut.: M. Macho , Historia , Química 1 Comment
La decisión se tomó en la 14e Conférence Générale des Poids et Mesures (CGPM), que es es el órgano de decisión de la Convención del Metro y tiene a su cargo tomar decisiones en materia de metrología y en particular, en lo que concierne al SI.
En la imagen anterior, extraída del informe de la CGPM de 1971, dice:
La Decimocuarta Conferencia General de Pesos y Medidas,
TENIENDO EN CUENTA las opiniones de la Unión Internacional de Física Pura y Aplicada, de la Unión Internacional de Química Pura y Aplicada y de la Organización Internacional de Normalización sobre la necesidad definir una unidad de cantidad de materia,
DECIDE
- El mol es la cantidad de sustancia de un sistema conteniendo tantas entidades elementales como átomos hay en 0,012 kilogramos de carbono 12; su símbolo es «mol».
- Cuando se emplea el mol, las entidades elementales deben especificarse y pueden ser átomos, moléculas, iones, electrones, otras partículas o agrupaciones especificadas de tales partículas.
- El mol es una unidad de base del Sistema Internacional de Unidades.
Por cierto, el 23 de octubre, se celebra el Día del Mol…
Os microscopios de van Leeuwenhoek
O seguinte artigo foi extraído da web da revista “Investigación y Ciencia“:
¿Cuántos microscopios originales de Leeuwenhoek existen?
Antonie van Leeuwenhoek (1632-1723) fue un comerciante de telas holandés aficionado a tallar lentes, pero ha pasado a los libros de historia como el padre de la microbiología, por sus excepcionales observaciones del mundo microbiano a través de unos sencillos microscopios que él mismo se construía. Sus descripciones sobre la maravillosa vida microscópica que se esconde en una gota de agua fueron recibidas al principio con escepticismo por muchos científicos de la época, incluso de la prestigiosa Royal Society londinense. Leeuwenhoek fue la primera persona que vio bacterias.
En realidad Leeuwenhoek no inventó el microscopio. Probablemente fue otro holandés Zacharias Janssen (1588-1638) quien construyó el primer microscopio compuesto de dos lentes, que consistía en un simple tubo de unos 25 cm de longitud y 9 cm de ancho con una lente convexa en cada extremo. Estos microscopios eran en realidad una lupa capaz de conseguir unos pocos aumentos.
 Microscopio de Jenssen.
Microscopio de Jenssen.
El inglés Robert Hooke (1635-1703), contemporáneo de Leeuwenhoek, publicó en 1665 el libro Micrographía, donde describía las observaciones que había llevado a cabo con un microscopio compuesto diseñado por él mismo de unos 30 aumentos. Este libro contiene por primera vez la palabra célula. Hooke descubrió las células observando en su microscopio una lámina de corcho, dándose cuenta de que estaba formada por pequeñas cavidades poliédricas que recordaban a las celdillas de un panal.

Microscopio de Hooke (dibujo original del propio Hooke).
Sin embrago, el microscopio de Leeuwenhoek era distinto. Consistía en una pequeña lente biconvexa montada sobre una placa de latón, que se sostenía muy cerca del ojo. Las muestras se montaban sobre la cabeza de un alfiler que se podía desplazar mediante unos tornillos que permitían enfocar. En realidad el microscopio de Leeuwenhoek era una simple lupa, pero de exquisita calidad, con la que podía alcanzar hasta 200 aumentos.

Microscopio de Leeuwenhoek (copia).
Leeuwenhoek descubrió por primera vez lo que él llamaría “animálculos“, y que en realidad hoy sabemos que son protozoos y bacterias. Fue el primero en ver los glóbulos rojos y los espermatozoides. Sus dibujos de bacterias publicados en 1684 son de una excelente calidad y nos permiten reconocer varios tipos de bacterias frecuentes: bacilos, cocos, grupos de cocos, etc.

Dibujos originales de Leeuwenhoek.
Se calcula que cuando Leeuwenhoek murió había unos 500 ejemplares de sus microscopios, que él y solo él construyó (1). Sin embargo, hasta hace poco se pensaba que hoy en día solo quedaban 8 ejemplares que se consideran auténticos (copias de los originales hay muchas, pero auténticos solo 8, … y quizás un par más, como veremos más adelante): seis de ellos son de latón y dos de plata, y tienen entre 68 y 266 aumentos. Siete de ellos están en museos y uno en una colección privada. En 2009 salió a subasta en la famosa galería Chisties’s un microscopio de Leeuwenhoek original de plata que se vendió por 321.237,50 libras. Sin embargo, este microscopio está en paradero desconocido.

Los 10 microscopios originales de Leeuwenhoek, según referencia (1). Existe un microscopio en el museo Royal Antwerp Zoological Society, pero según Brian J. Ford se trata de una copia antigua (2).
Leeuwenhoek fue muy celoso con sus microscopios. No compartió con nadie su forma de pulir o tallar las lentes y no dejó ninguna indicación sobre sus métodos de fabricación. Probablemente destruyó muchos de sus microscopios. Nunca vendió ninguno. La ciencia tardó casi 200 años en volver a desarrollar una técnica equivalente. Se cree que regaló dos a la Reina María II de Inglaterra, pero nunca se han encontrado dichos microscopios. A su muerte, legó 26 microscopios a la Royal Society que nunca fueron utilizados y que, un siglo más tarde, se habían perdido, probablemente en un incendio.
El misterio del microscopio encontrado en el lodo
Pero, ¿hay más microscopios de Leeuwenhoek por ahí fuera? Según Brian J. Ford, uno de los mayores expertos del mundo en el tema, en los últimos meses han aparecido dos más (2). Uno de ellos, todavía en estudio, ha aparecido para su venta de nuevo en la galería Christie’s. El otro tiene una historia todavía más curiosa. En diciembre de 2014 aparece para la venta en eBay un lote por 99 dólares de algunos “utensilios médicos” y un par de monedas viejas encontrados en los lodos de los canales de Delft (ciudad holandesa de donde era original Leeuwenhoek). En los años 80 se drenaron y limpiaron los canales y todo el barro y el lodo acabó en unos parques. Algunos coleccionistas amateurs se dedican a tamizar los lodos y buscar piezas antiguas. Entre las piezas aparece un utensilio que bien podría tratarse de un microscopio como los de Leeuwenhoek. Un coleccionista español se hace con el lote por un precio final de 1500 euros. Los análisis que ha llevado a cabo Brian J. Ford (3) en el laboratorio Cavendish de la Universidad de Cambridge demuestran que este microscopio encontrado en los lodos de Delft es indistinguible de los originales.

Fotografía de los “utensilios médicos” y monedas viejas encontrados en los lodos de los canales de Delft y subastados en eBay. En el centro se observa el microscopio de Leeuwenhoek, cuya placa había sido rotada 90 grados. Referencia (2).
Por tanto, de aquellos 500 parece que solo han llegado a nuestros días 10. El último encontrado entre el barro y los lodos de los canales de Delft. Mucha gente tira al río o a los canales cosas que le sobran, unas monedas, unas llaves… quizá hace unos cientos de años fue el propio Antonie van Leeuwenhoek quien se deshizo de algunos de sus microscopios. Quizás ahora comience una auténtica “fiebre del oro” entre los coleccionistas para encontrar nuevas reliquias del padre de la microbiología.
Lo que vio Antonie van Leeuwenhoek a través de su microscopio. Vídeo (2:02) realizado por Lesley A. Robertson con una replica del microscopio de Leeuwenhoek.
(1) van Leeuwenhoek microscopes-where are they now? Robertson, L.A. 2015. FEMS Microbiology Letters, 362 (9): fnv056. doi: 10.1093/femsle/fnv056.
(2) Deepening mystery of the disappearing microscope. Brian J. Ford. 2015. Laboratory News (February).
(3) The mystery of the microsocope in mud. Brian J. Ford. 2015. Nature 521: 423.
Os inicios da electricidade
Aínda que a electricidade xa era coñecida polo home, é no s. XVIII cando se estuda empregando unha sistemática científica. Nos seguintes vídeos podes aprender un pouco máis sobre isto:
Como sucede con frecuencia en ciencia, un descubrimento casual supón o inicio dunha morea de acontecementos que desencadean importantísimas conclusións e poden levar ao inicio de novos camiños de investigación. Foi o que sucedeu con Galvani a finais do s. XVIII, quen observou o movemento das patas dunha ra morta cando a tocaba con dous instrumentos de metais distintos. Atribuiuno a unha “forza vital” propia dos animais.
Pronto, Volta decatouse de que o impulso eléctrico proviña do contacto entre os dous metais a través da ra, quen actuaba como simple condutora. O contacto entre os dous metais xeraba unha corrente eléctrica que Volta logrou optimizar enfrentando Cu e Zn, pois era a parella que máis descarga lle producía na lingua. Volta inventou así a pila. Este dispositivo pasou a substituir á botella de Leyden, o dispositivo empregado ata o momento polos científicos, pero moi incómodo, pois unha vez descargado, había que cargalo de novo. A explicación de Galvani non era correcta, pero foi o primeiro en ralacionar a contracción muscular cos impulsos eléctricos, o que supuxo o inicio da neurofisioloxía.
Le todo o relacionado con estes achados no seguinte traballo:
Olla estes vídeos para aprender máis:






