Revisa a formulación e nomenclatura orgánicas nesta ligazón:
Fai clic para acceder a Ejercicios%20formulacion%20organica%20con%20solucion.pdf

Revisa a formulación e nomenclatura orgánicas nesta ligazón:
Fai clic para acceder a Ejercicios%20formulacion%20organica%20con%20solucion.pdf
Nesta ligazón podes traballar coa formulación. Segue as indicacións da/o profesora/o para empregar o sistema de nomenclatura máis axeitado.
O pH de moitas augas de chuvia chega a ser de 4,2-4,3, o que indica un grao de acidez moi alto. Esta é a “chuvia ácida”. É a consecuencia do arrastre de diversas substancias na auga de chuvia.
– Causas do incremento da acidez da auga de chuvia
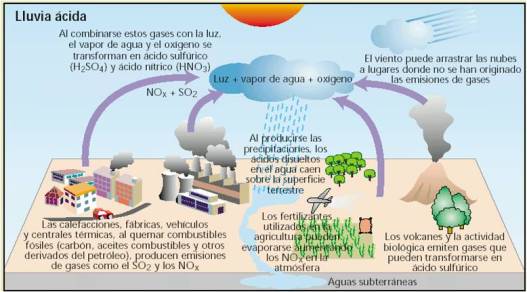
A actividade humana produce a emisión á atmosfera de gases que, combinados coa auga, xeneran ácidos. Estes gases son, principalmente, os óxidos de xofre (SOx, estímase que contribúen nun 60 – 70%) e os óxidos de nitróxeno (NOx, contribúen en torno ao 30%); a porcentaxe restante, en torno a un 6%, sería responsabilidade doutras especies químicas.

Estes gases orixínanse, fundamentalmente, en procesos de combustión, tanto a nivel doméstico (calefaccións), como a nivel industrial (obtención de enerxía eléctrica por combustións en caldeiras) e, ademáis, nos motores dos medios de transporte nos que se queiman combustibles.
combustible+O2 –> outros produtos da combustión +CO2+SO2 +NOx+H2O+enerxía térmica
Os gases emitidos á atmosfera reaccionan coa auga:
NOx + H2O –> HNO3
CO2 + H2O –> H2CO3
SOx + H2O –> H2SO4
– Efectos da chuvia ácida
A chuvia ácida xenera multitude de efectos nocivos, tanto sobre os ecosistemas como sobre los materiais:


CaCO3 (pedra caliza)+H2SO4 (chuvia ácida) –> CaSO4 (yeso)+CO2+H2O
O problema é que o CaSO4 disólvese en auga con máis facilidade que a pedra caliza CaCO3, así que a pedra vaise deteriorando coa chuvia. Mirade a fotografía, que amosa a escultura de arenisca do Castelo de Herten, Recklinghausen, no Rhin (Alemania) e construído en 1702. Na foto da esquerda vedes o aspecto en 1908, moderadamente deteriorado e, á dereita, a mesma escultura en 1969, prácticamente destruída.

Neste vídeo podedes ver como os ácidos atacan ao CaCO3 do xiz. Fórmase CO2 (burbullas) e o xiz vaise disolvendo:
-Como axudar a eliminar a chuvia ácida
Hai que reducir a produción de contaminantes, a través dos seguintes medios: